| 研发人员要从零开始工作。他们必须找出所有相关的材料,对所有必要的程序进行验证,并要进行关键于产品「首次」获批上市的多种研究项目(包括临床前和临床研究)。 |
|
仿制药制造商,可节省开发的成本,因汲取了前人的制药经验;不必「重做」一些原研发者投入了很多时间金钱,且是繁琐的研究工作。
|
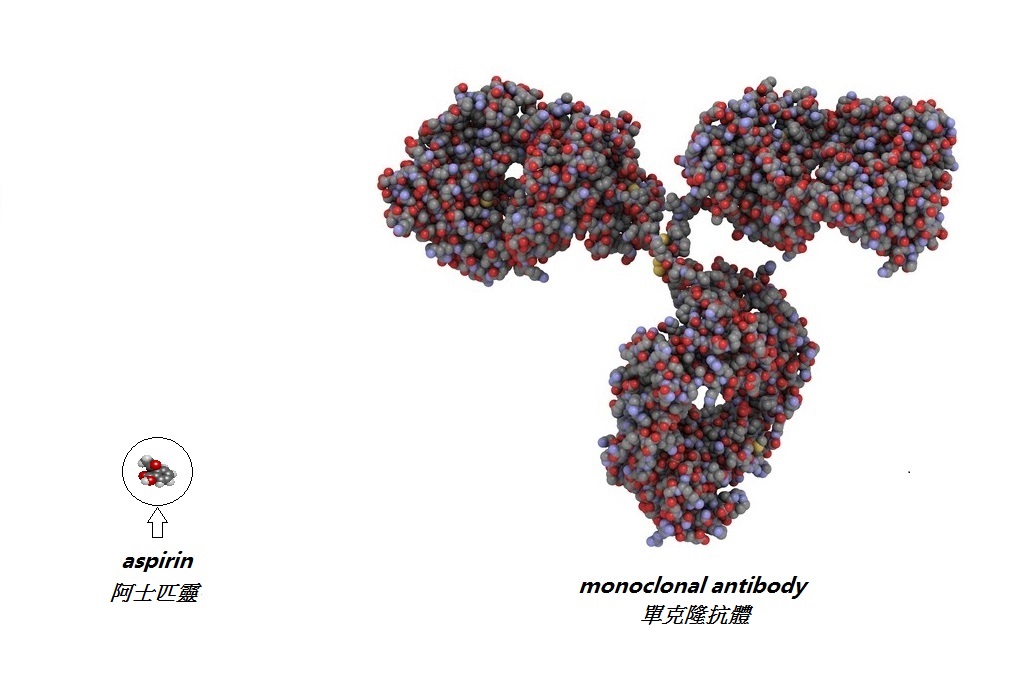
| 但是复制生物产品,仍需要多方面的专门技术和保证品质安排。生产的原材料有严谨且特殊的要求(例如,所采用的细胞品种来源专属);另外生产过程亦会受到生产条件轻微变化(例如温度、配方和容器物料)所影响。原材料与生产的条件尽管只有细小的变化,也能对最终的产品造成大改变。因此,为了确保所生产的生物制品(不论是原研发药或生物相类似药)的质量能够保持平均与一致,须实施严格的质量监控。 |
|
事实上,即使在原研发者的厂房内,并且已严谨地遵守生产标准,生物制品仍会出现一些自然的差异。而原研发者一般也会制定些「标准」测试,以保证所制造出来的产品,能拥有一些发挥功效的重要特性。于产品内,存在着的细小变异的情况,在专业术语称之为「微观异质性」。
|
 |
| |
| 因此,负责仿制的厂商的目标就是,要把「生物相类似药」和「原研发药」的差异减至最低。它会以原研发者的生产和检测方法为蓝本,务求使仿制的产品与原创的产品有很大程度上相「近似」。 |
| |
| 高灵敏度的动物和人体测试(即:一些比对研究),一般都可采纳用于侦测原研发药与「生物相类似药」之间有甚么少许的差别。换句话说,这就是要排除该两种产品之间于临床疗效和安全性,会有显著差异的可能。 |
| |
| 有时,供参照的原创产品可能会有多于一项的适应症(「适应症」是指:标示于药品内,注明该产品可适应于及可治疗于一些疾病或症状的项目)。那么,如果临床的比对研究(人体测试)能够证明该生物相类似药,在「已研究的」某一适应症的范畴与与参照品的疗效「相类似」的话;则就可以预期该生物相类似药(但须个别个案考虑)也能获准用作,该参照品已获批准的其他适应症。把生物相类似药附加上适应症,专业术语上常简称为「外推」(即:向外推算演绎药品的应用范围)。 |
|